कार्बन की उपस्थिति
कार्बन का परिचय:
कार्बन एक अधातु है, इसका रासायनिक प्रतिक चिन्ह C है तथा परमाणु क्रमांक 6 है | प्राकृतिक रूप से इसके समस्थानिकों की संख्या तीन है जो 12C, 13C तथा 14C हैं | इसका इलेक्ट्रोनिक विन्यास 2, 4 है तथा संयोजकता 4 है इसलिए यह चतुर्संयोजक है |
भोजन, कपड़े, दवाइयाँ, पुस्तकें या अन्य बहुत सी वस्तुएं जिसे आप सूचीबद्ध कर सकते हैं सभी इस सर्वतोमुखी तत्व कार्बन पर आधारित है | दुसरे शब्दों में, सभी सजीव आकृतियाँ कार्बन से बनी हैं |
कार्बन की उपस्थिति :
कार्बन के अपररूप:
अपररूप: किसी तत्व के वे विभिन्न रूप जिनकी भौतिक गुण तो अलग-अलग होते है परन्तु रासायनिक गुणधर्म सामान होते है वे उस तत्व के अपररूप कहलाते है |
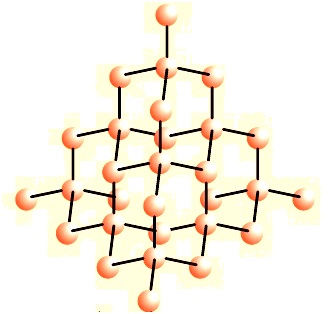
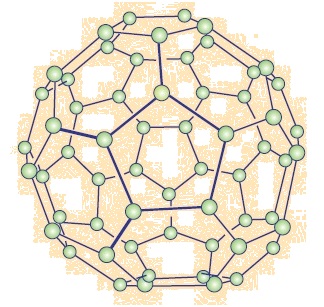
कार्बन के तीन अपररूप जो अच्छी तरह ज्ञात हैं, वे हैं ग्रेफाइट, हीरा तथा बक मिनस्टर फुलेरिन जो कार्बन अणुओं से बने है |
ग्रेफाइट (Graphite) : प्रत्येक कार्बन अणु तीन अन्य कार्बन अणुओं से उसी तल में बने हैं जिससे षटकोणीय व्यूह मिलता है | इनमें से एक आबंध द्विआबंध होता है | इस प्रकार कार्बन की संयोजकता संतुष्ट हो जाती है | ग्रेफाइट विद्युत का एक बहुत ही अच्छा सुचालक है जबकि अन्य अधातु सुचालक नहीं होते हैं |

(ii) ये चार इलेक्ट्राॅन खो कर C4+ धनायन बना सकता है। लेकिन चार इलेक्ट्राॅनों को खो कर छः प्रोटाॅन वाले नाभिक में केवल दो इलेक्ट्राॅनों का कार्बन धनायन बनाने के लिए अत्यधिक ऊर्जा की आवश्यकता होगी।
रासायनिक बंध (Chemical Bond):
किसी यौगिक में तत्वों के परमाणुओं के बीच लगने वाले बल से बनने वाले आबंध को रासायनिक आबंध कहते हैं |
रासायनिक आबंध दो प्रकार के होते हैं |
(i) आयनिक आबंध (Ionic Bond): वह आबंध जो इलेक्ट्रानों के पूर्णत: स्थानान्तरण के द्वारा होता है आयनिक आबंध कहलाता है | उदाहरण:
Na+ + Cl– ——-> NaCl
(ii) सह्संयोजी आबंध (Covalent Bond): वह आबंध जो दो परमाणुओं के बीच इलेक्ट्रोनों के एक युग्म की साझेदारी से आबंध बनता है सह्संयोजी आबंध कहलाता है |
सहसंयोजी आबंध के प्रकार (Types of Covalent Bond):
सह्संयोजी आबंध के तीन प्रकार होते हैं :
(A) एकल सहसंयोजी आबंध (Single Covalent Bond): दो परमाणुओं के बीच एक एक इलेक्ट्रोन के युग्म की साझेदारी से बनने वाले संयोजी आबंध को एकल आबंध कहते हैं | यह दो अणुओं के बीच एक रेखा ( – ) द्वारा इसे प्रदर्शित किया जाता है |.
उदाहरण: H – H, Cl – Cl, Br – Br
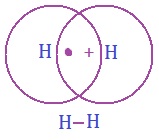
हाइड्रोजन परमाणुओं के बीच एकल आबंध
(B) द्वि सह्संयोजी आबंध (Double Covalent Bond): दो परमाणुओं के बीच दो दो इलेक्ट्रोनों की साझेदारी से बनने वाले सहसंयोजी आबंध को द्वि आबंध कहते हैं | इसे दो परमाणुओं के बीच दो छोटी रेखाओं (=) से प्रदर्शित किया जाता है |.
O=O [ऑक्सीजन से ऑक्सीजन के बीच द्वि-आबंध ]
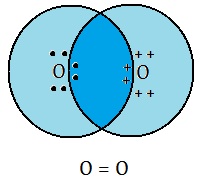
ऑक्सीजन परमाणुओं के बीच द्वि-आबंध
(C) त्रि सह्संयोजी आबंध (Triple Covalent Bond): दो परमाणुओं के बीच तीन-तीन इलेक्ट्रोनों की साझेदारी से बनने वाले आबंध को त्रि-आबंध कहते है | यह दो परमाणुओं के बीच तीन छोटी रेखाओं (≡) द्वारा दर्शाया जाता है |
N ≡ N [नाइट्रोजन से नाइट्रोजन]
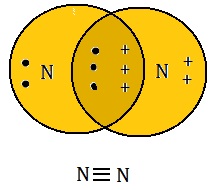
नाइट्रोजन का नाइट्रोजन के बीच त्रि आबंध
सहसंयोजी आबंध बनाने वाले यौगिकों के गुण :
(i) सह्संयोजी आबंध बनाने वाले यौगिकों के अणुओं के बीच प्रबल आबंध होता है |
(ii) इनमें अंतराणुक बल कम होता है |
(iii) इनका गलनांक एवं क्वथनांक भी कम होता है |
(iv) ये यौगिक सामान्यत: विद्युत के कुचालक होते हैं |
Science Notes के अपडेटेड लगातार हासिल करने के लिए हमें Facebook पर ज्वाईन करे | Click Now
कार्बन के अन्य गुण (Some Other Properties of Carbon):
1. श्रृंखलन (Catenation): कार्बन में कार्बन के ही अन्य परमाणुओं के साथ आबंध बनाने की अद्वितीय क्षमता होती है जिससे बड़ी संख्या मे अणु बनते हैं। इस गुण को श्रृंखलन
(Catenation) कहते हैं।
सह्संयोजी आबंध की प्रकृति कार्बन को बड़ी संख्या में यौगिक बनाने का गुण देता है |
2. चतुर्संयोजकता (Tetravalency): कार्बन की संयोजकता चार होती है, अतः इसमें कार्बन के चार अन्य परमाणुओं अथवा कुछ अन्य एक संयोजक तत्वों के परमाणुओं के साथ आबंधन
की क्षमता होती है। कार्बन के इस गुण को कार्बन की चतुसंयोजकता कहते है |
कार्बन बंध के कुछ गुण (Somes Features of Carbon Bond):
(i) अधिकतर अन्य तत्वों के साथ कार्बन द्वारा बनाए गए आबंध अत्यंत प्रबल होते
हैं जिनके फलस्वरूप ये यौगिक अतिशय रूप में स्थायी होते हैं।
(ii) कार्बन द्वारा प्रबल आबंधों के निर्माण का एक कारण इसका छोटा आकार भी है।
(iii) इसके कारण इलेक्ट्राॅन के सहभागी युग्मों को नाभिक मज़बूती से पकड़े रहता है।
(iv) बड़े परमाणुओं वाले तत्वों से बने आबंध तुलना में अत्यंत दुर्बल होते हैं।
कार्बन द्वारा बने यौगिक और अन्य दुसरे बड़े परमाणुओं द्वारा बने यौगिकों में अंतर :
कार्बन द्वारा प्रबल आबंधों के निर्माण का एक कारण इसका छोटा आकार भी है। इसके कारण इलेक्ट्राॅन के सहभागी युग्मों को नाभिक मज़बूती से पकड़े रहता है। बड़े परमाणुओं वाले तत्वों से बने आबंध तुलना में अत्यंत दुर्बल होते हैं।
कार्बन द्वारा बड़ी संख्या में यौगिक निर्मित होते हैं |
कार्बन के निम्नलिखित गुणों के कारण प्रकृति में बड़ी संख्या में कार्बनिक यौगिक बनते हैं |
(i) सहसंयोजी आबंध का बनाना (Forming covelent bond): सहसंयोजी आबंध बनाने के गुण के कारण कार्बन बड़ी संख्या में यौगिक का निर्माण करता है |
(ii) श्रृंखलन (Catenation): कार्बन-कार्बन बंध बहुत ही मजबूत और स्थायी होता है | इसके कारण कार्बन से ही कार्बन में एक दुसरे से जुड़कर बड़ी संख्या में यौगिक देता है |
(iii) चतुसंयोजकता (Tetravalency): चूँकि कार्बन की संयोजकता चार होती है, अतः इसमें कार्बन के चार अन्य परमाणुओं अथवा कुछ अन्य एक संयोजक तत्वों के परमाणुओं के साथ आबंधन की क्षमता होती है। जिसके कारण बड़ी संख्या में यौगिक बनाता है |
हाइड्रोकार्बन (Hydrocarbons)
हाइड्रोकार्बन (Hydrocarbons): वे सभी कार्बन यौगिक जो सिर्फ कार्बन और हाइड्रोजन से बने है हाइड्रोकार्बन कहलाते हैं |
कार्बनिक यौगिकों के सूत्र (Formulae of organic compounds):
(i) समान्य सूत्र (General formula): किसी अणु में प्रत्येक परमाणु के n संख्या के लिए प्रदर्शित करने वाले फलन (function) को समान्य सूत्र कहते हैं |
उदाहरण: एल्केन के लिए: CnH2n+2
(ii) अणु सूत्र (Molecular formula): अणु सूत्र किसी अणु में परमाणुओं के वास्तविक संख्या को प्रदर्शित करता है |
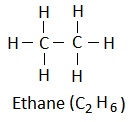
उदाहरण: एथेन के लिए : C2H6
2 कार्बन और 6 हाइड्रोजन
(iii) संक्षिप्त सूत्र (Condensed formula): संक्षिप्त सूत्र प्रत्येक कार्बन परमाणु से जुड़े परमाणुओं के समूह को प्रदर्शित करता है |
उदाहरण: एथेन के लिए: CH3CH3
(iv) संरचना सूत्र (Structural formula): Itयह किसी अणु के परमाणुओं के ठीक-ठीक व्यवस्था को दर्शाता है |
उदाहरण: एथेन के लिए:
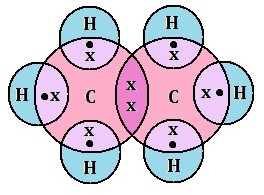
(v) इलेक्ट्रोनिक सूत्र (Electronic formula): इलेक्ट्रॉनिक सूत्र किसी अणु के परमाणुओं के बीच इलेक्ट्रोनों की साझेदारी को प्रदर्शित करता है | इसे इलेक्ट्रोन बिंदु संरचना सूत्र भी कहते हैं |
उदाहरण: एथेन के लिए इलेक्ट्रोन बिंदु संरचना सूत्र:
संतृप्त कार्बन यौगिक (Saturated Carbon Compounds):
वह कार्बन यौगिक जो कार्बन-कार्बन परमाणुओं से केवल एकल आबंध से जुड़े होते है संतृप्त कार्बन यौगिक कहलाते हैं |
उदाहरण: सभी एल्केन जैसे मीथेन, इथेन, प्रोपेन और ब्युटेंन आदि |
एल्केन का समान्य सूत्र (General formula): CnH2n+2
मीथेन का सूत्र प्राप्त करने के लिए इस सूत्र का प्रयोग:
CnH2n+2
n =1 रखने पर हम पाते हैं :
C1H2×1 + 2
CH4
इसी प्रकार;
इथेन के लिए:
n =2 रखने पर हमें प्राप्त होता है :
C2H2×2 + 2
C2H6
ऐसे ही हम प्रोपेन, ब्यूटेन और पेंटेन आदि का भी ज्ञात कर सकते है |
एल्केन (Alkanes): The संतृप्त हाइड्रोकार्बन जिसमें कार्बन परमाणु केवल एकल आबंध से जुड़े रहते है एल्केन कहलाता है |
| एल्केन का नाम | अणु सूत्र | संक्षिप्त संरचना सूत्र (Condensed Formula) |
| मीथेन | CH4 | CH4 |
| इथेन | C2H6 | CH3CH3 |
| प्रोपेन | C3H8 | CH3CH2CH3 |
| ब्यूटेन | C4H10 | CH3CH2CH2CH3 |
| पेंटेन | C5H12 | CH3CH2CH2CH2CH3 |
| हेक्सेन | C6H14 | CH3CH2CH2CH2CH2CH3 |
| हेप्टेन | C7H16 | CH3CH2CH2CH2CH2CH2CH3 |
| ओक्टेन | C8H18 | CH3CH2CH2CH2CH2CH2CH2CH3 |
| नोनेन | C9H20 | CH3CH2CH2CH2CH2CH2CH2CH2CH3 |
| डेकेन | C10H22 | CH3CH2CH2CH2CH2CH2CH2CH2CH2CH3 |
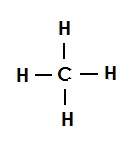
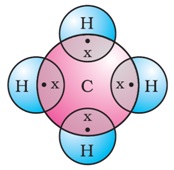
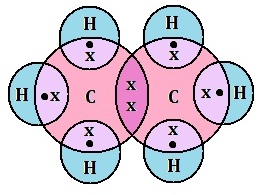
मीथेन की संरचना (एकल आबंध):
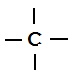
अकेला कार्बन परमाणु जिसकी चार असंतुष्ट संयोजकता होती है हाइड्रोजन के परमाणुओं से इस आकृति की तरह जुड़ा होता है |
इथेन की संरचना (एकल आबंध):
C – C [ कार्बन परमाणु एकल आबंध से एक दुसरे से जुड़े रहते हैं |]
दिए गए आकृति की तरह कार्बन के बाकी असंतुष्ट संयोजकता को हाइड्रोजन परमाणुओं से जोडिए |
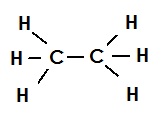
इसी प्रकार
प्रोपेन का संरचना सूत्र (एकल आबंध):
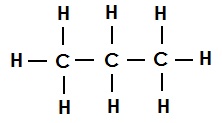
ब्यूटेन का संरचना सूत्र (एकल आबंध):
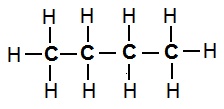
पेंटेन का संरचना सूत्र (एकल आबंध):
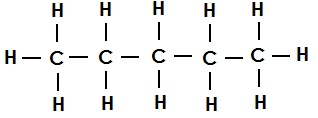
हेक्सेन का संरचना सूत्र (एकल आबंध):
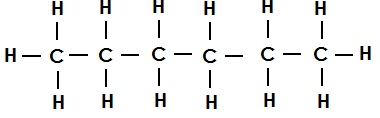
असंतृप्त कार्बन यौगिक (Unsaturated Carbon Compounds):
वे कार्बन यौगिक जिनके कार्बन परमाणुओं के बीच द्वि-आबंध या त्रि-आबंध होता है उन्हें असंतृप्त कार्बन यौगिक कहते हैं |
उदाहरण : एल्किन और एल्काइन |
एल्किन की संरचना (Structure of alkenes):
एल्किन का समान्य सूत्र (General Formula): CnH2n है |
सबसे सरलतम एल्किन का नाम एथीन (C2H4) है |
चूँकि एथीन में 2 कार्बन परमाणु होते हैं |
इसलिए, अब समान्य सूत्र में n = 2 रखने पर;
C2H2×2 = C2H4
प्रोपीन में 3 कार्बन के परमाणु होते हैं ;
अत: समान्य सूत्र में n = 3 रखने पर;
C3H2×3 = C3H6
इसीप्रकार, हम अन्य दुसरे एल्किन जैसे ब्युटिन, पेंटीन और हेक्सिन आदि को कार्बन परमाणुओं को n मानकर समान्य सूत्र में मान रखकर प्राप्त कर सकते है |
एल्किन (Alkenes): The असंतृप्त हाइड्रोकार्बन जिनमें कार्बन-कार्बन परमाणुओं के बीच द्वि-आबंध होता है एल्किन कहलाता है |
सबसे सरलतम एल्किन का नाम एथीन है |
| एल्किनों के नाम | अणु सूत्र | संक्षिप्त संरचना सूत्र |
| एथीन | C2H4 | CH2=CH2 |
| प्रोपीन | C3H6 | CH3CH=CH2 |
| ब्युटिन | C4H8 | CH3CH2CH=CH2 |
| पेंटीन | C5H10 | CH3CH2CH2CH=CH2 |
| हेक्सिन | C6H12 | CH3CH2CH2CH2CH=CH2 |
| हेप्टीन | C7H14 | CH3CH2CH2CH2CH2CH=CH2 |
| ओक्टीन | C8H16 | CH3CH2CH2CH2CH2CH2CH=CH2 |
| नोनीन | C9H18 | CH3CH2CH2CH2CH2CH2CH2CH=CH2 |
| डेकीन | C10H20 | CH3CH2CH2CH2CH2CH2CH2CH2CH=CH2 |
एल्किन का संरचना सूत्र (Structural Formula of Alkene):
| एल्किन का नाम | अणु सूत्र | संरचना सूत्र |
| एथीन | C2H4 | 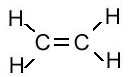 |
| प्रोपीन | C3H6 | 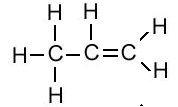 |
| ब्युटिन | C4H8 | 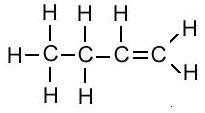 |
| पेंटीन | C5H10 | 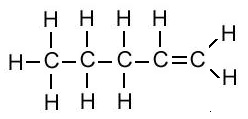 |
| हेक्सिन | C6H12 | 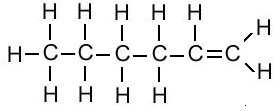 |
| हेप्टीन | C7H14 | 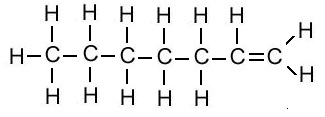 |
| ओक्टीन | C8H16 | 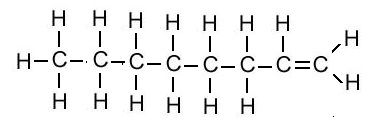 |
| नोनीन | C9H18 | 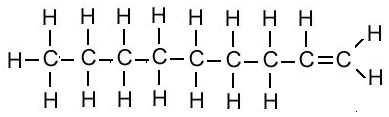 |
| डेकीन | C10H20 | 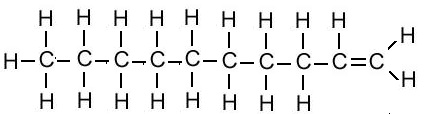 |
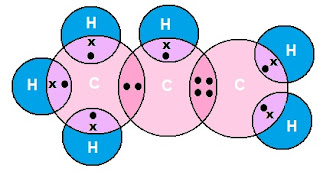
एथीन का इलेक्ट्रोन डॉट संरचना (Electron Dot Structure of Ethene):
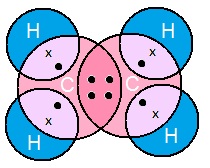
एथीन (C2H4)
प्रोपीन का इलेक्ट्रोन डॉट संरचना (Electron Dot Sructure of Propene):
प्रोपीन (C2H4)
इसीप्रकार हम अन्य सभी एल्किनों का इलेक्ट्रोन डॉट संरचना बना सकते हैं |
एल्काइन की संरचना (Structure of Alkynes)Triple Bond:
एल्काइन का समान्य सूत्र : CnH2n-2
एथाइन एल्काइन समूह का सबसे सरलतम अणु है |
एथाइन में दो कार्बन परमाणु होते हैं |
अत: सूत्र के प्रयोग करने पर;
एथाइन के लिए n = 2 रखने पर,
C2H2×2-2 = C2H2
∴ एथाइन = C2H2
इसी प्रकार प्रोपाइन का अणु सूत्र प्राप्त करने के लिए;
n=3 रखने पर;
C3H2×3-2 = C3H4
∴ प्रोपाइन = C3H4
एल्काइन (Alkynes):
| एल्काइन का नाम | अणु सूत्र | संक्षिप्त संरचना सूत्र |
| एथाइन | C2H2 | CH≡CH |
| प्रोपाइन | C3H4 | CH≡CCH3 |
| 1-ब्युटाइन | C4H6 | CH≡CCH2CH3 |
| 1-पेंटाइन | C5H8 | CH≡CCH2CH2CH3 |
| 1-हेक्साइन | C6H10 | CH≡CCH2CH2CH2CH3 |
| 1-हेप्टाइन | C7H12 | CH≡CCH2CH2CH2CH2CH3 |
| 1-ओक्टाइन | C8H14 | CH≡CCH2CH2CH2CH2CH2CH3 |
| 1-नोनाइन | C9H16 | CH≡CCH2CH2CH2CH2CH2CH2CH3 |
| 1-डेकाइन | C10H18 | CH≡CCH2CH2CH2CH2CH2CH2CH2CH3 |
लंबी चैन वाले सूत्रों को संक्षिप्त रूप में निम्नप्रकार से लिखते है |
[नोनाइन] CH≡CCH2CH2CH2CH2CH2CH2CH3 को इस प्रकार लिखते है :
CH≡C (CH2)6CH3
इसी प्रकार;
[डेकाइन] CH≡CCH2CH2CH2CH2CH2CH2CH2CH3 को भी इसी प्रकार से लिखते हैं |
CH≡C (CH2)7CH3
संतृप्त और असंतृप्त कार्बन यौगिक में अंतर :
| संतृप्त यौगिक | असंतृप्त यौगिक |
| 1. इसमें कार्बन परमाणुओं के बीच एकल आबंध होता है | 2. इनमें प्रतिस्थापन अभिक्रिया होती है | 3. ये असंतृप्त यौगिक के तुलना में कम अभिक्रियाशील होते हैं 4. उदाहरण : एल्केन | |
1. इसमें कार्बन परमाणुओं के बीच द्वि-आबंध होता है | 2. इसमें संयोजन अभिक्रिया होती है | 3. ये संतृप्त यौगिक की तुलना में अधिक अभिक्रियाशील होते है | 4. उदाहरण: एल्किन और एल्काइन | |
Science Notes के अपडेटेड लगातार हासिल करने के लिए हमें Facebook पर ज्वाईन करे | Click Now
कार्बन कंकाल एवं संरचनात्मक समन्वयन
Making Carbon Skeletons:
Skeletons of Carbon Atoms:
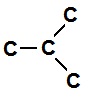
(i) Straight Carbon chain: When carbon atoms are linked together in staight chain.
E.g:
C-C-C-C
(ii) Branches Carbon chain: When carbon atoms are linked together in straight chain.
E.g:
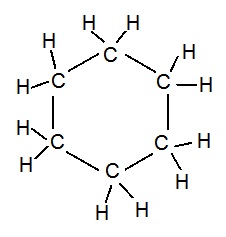
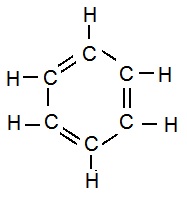
(iii) Ring Carbon chain: When carbon atoms are linked together in ringh shape.
E.g:

Structural Isomers:
Compounds with identical molecular formula but different structures are called structural isomers.
Example 1: Structural Isomers of Butane; Whose molecular formula is C4H10.
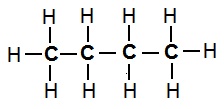
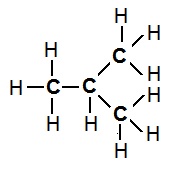
Structure Isomer (I) of Butane Structure Isomer (II) of Butane
Example 2: Structural Isomers of Butene (double bond); Whoose molecular formula is C4H8.
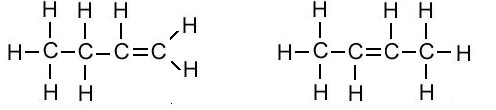
Structure Isomer (I) of Butene Structure Isomer (II) of Butene
Ring Skeletons in Hydrocarbons:
प्रकार्यात्मक समूह
प्रकार्यात्मक समूह:
प्रकार्यात्मक समूह किसी कार्बोनिक यौगिकों में परमाणुओं अथवा परमाणुओं का समूह है जो एक दुसरे से एक विशेष प्रकार से जुड़े होते हैं | यही कारण है कि आमतौर पर कार्बन यौगिकों में रासायनिक अभिक्रिया का क्षेत्र है |
कार्बन यौगिकों में प्रकार्यात्मक समूह के रूप में ऑक्सीजन, क्लोरीन, सल्फर, नाइट्रोजन और अन्य दुसरे तत्व के परमाणु उपस्थित हो सकते है |
विषमपरमाणु (Hetroatoms): किसी यौगिक से हाइड्रोजन परमाणुओं को प्रतिस्थापित करने वाले तत्व को विषमपरमाणु कहते हैं |
उदाहरण: ऑक्सीजन, क्लोरीन, सल्फर, नाइट्रोजन और अन्य तत्वों कार्बोनिक यौगिकों में एक कार्यात्मक समूह के एक भाग के रूप में उपस्थिति हो सकता है, इस तरह के तत्वों विषमपरमाणु कहा जाता है।
कुछ प्रकार्यात्मक समूहों की सूचि (Some List of Functional Groups):
(i) हैलोजन (Halogen): हैलोजन में क्लोरीन, फ़्लोरिन, ब्रोमिन और आयोडीन आदि जैसे अधातु होते है जो आधुनिक आवर्त सारणी के समूह 17 में स्थित हैं |
| प्रकार्यात्मक समूह | प्रकार्यात्मक समूह का सूत्र | विषमपरमाणु |
| हैलोजन | -Cl (क्लोरो उपसर्ग लगता है ) -Br (ब्रोमो उपसर्ग लगता है) -I (आयोडो उपसर्ग लगता है) |
Cl (क्लोरीन) Br (ब्रोमिन) I (आयोडीन) |
(ii) अल्कोहल (Alcohol): अल्कोहल एक अन्य प्रकार्यात्मक समूह है जो हाइड्रोकार्बन की श्रृंखलाओं से जुड़कर अणुओं का समूह बनाता है | इसमें हाइड्रोऑक्साइड (-OH) हाइड्रोकार्बन से एक हाइड्रोजन परमाणु को हटाकर स्वयं जुड़ता है और अल्कोहल समूह का यौगिक बनाता है |
उदाहरण: – OH
(-OH) एल्केन जैसे हाइड्रोकार्बन से जुड़कर अनेक प्रकार के अल्कोहल का निर्माण करता है जैसे – मेथनॉल, एथेनॉल और प्रोपनॉल आदि |
(iii) एल्डिहाईड (Aldehyde): यह एक प्रकार्यात्मक समूह है जिसमें एक अकेला ऑक्सीजन परमाणु द्वि-आबंध में हाइड्रोजन के साथ कार्बन परमाणु से जुड़ता है |
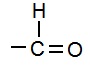
(iv) किटोन (Ketone): किटोन भी एक प्रकार्यात्मक समूह है जो हाइड्रोकार्बन से जुड़कर अनेक अणुओं का निर्माण करता है | किटोन समूह में कार्बन परमाणु एक अकेले ऑक्सीजन परमाणु से द्वि-आबंध में जुड़ा होता है |
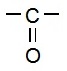
(v) कार्बोक्सिलिक अम्ल (Carboxylic acid): यह भी एक प्रकार्यात्मक समूह है जिसमें एक कार्बन परमाणु, ऑक्सीजन परमाणु से द्वि-आबंध में जुड़ा होता है और हाइड्रोऑक्साइड से भी जुड़ा होता है |
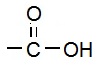
समजातीय श्रेणी (Homologous Series):
यौगिकों की एक श्रृंखला जिसमें एक ही प्रकार के प्रकार्यात्मक समूह कार्बन श्रृंखला में हाइड्रोजन परमाणु को प्रतिस्थापित करता है और अणुओं की एक श्रृंखला का निर्माण करता है इसे समजातीय श्रेणी कहते हैं |
समजातीय श्रेणियों का उदाहरण:
| एल्केन के साथ कार्बन श्रृंखला | समजातीय श्रेणी हैलोजन (-Cl) के साथ | समजातीय श्रेणी हैलोजन (-Br) के साथ | समजातीय श्रेणी हैलोजन (-I) के साथ | समजातीय श्रेणी अल्कोहल के साथ(-OH) | एल्डिहाईड के साथ समजातीय श्रेणी (-CHO) | ||
| CH4 | CH3-Cl | CH3-Br/td> | CH3-I | CH3-OH | H-CHO | ||
| C2H6 | C2H5-Cl | C2H5-Br | C2H5-I | C2H5-OH | CH3-CHO | ||
| C3H8 | C3H7-Cl | C3H7-Br | C3H7-I | C3H7-OH | C2H5-CHO | ||
| C4H10 | C4H9-Cl | C4H9-Br | C4H9-I | C4H9-OH | C3H7-CHO | ||
| C5H12 | C5H11-Cl | C5H11-Br | C5H11-I | C5H11-OH | C4H9-CHO | ||
| C6H14 | C6H13-Cl | C6H13-Br | C6H13-I | C6H13-OH | C5H11-CHO |
समजातीय श्रृंखला में बढ़ते अणु द्रव्यमान:
जब किसी समजातीय श्रेणी में आणविक द्रव्यमान बढ़ता है तो भौतिक गुणधर्मों में
क्रमबद्धता दिखाई देती है। ऐसा इसलिए होता है क्योंकि आणविक द्रव्यमान के बढ़ने के
साथ गलनांक एवं क्वथनांक में वृद्धि होती है। किसी विशेष विलायक में विलेयता जैसे
भौतिक गुणधर्म भी इसी प्रकार की क्रमबद्धता दर्शाते हैं।किन्तु पूर्ण रूप से प्रकार्यात्मक
समूह के द्वारा सुनिश्चित किए जाने वाले रासायनिक गुण समजातीय श्रेणी में एकसमान बने रहते हैं।
कार्बन यौगिकों का नामकरण (Nomenclature of carbon Compounds):
कार्बनिक यौगिकों का व्यवस्थित ढंग से नामकरण को नामकरण (nomenclature) कहते हैं ।
IUPAC नाम:
इस नामकरण से बनने वाले नाम को IUPAC नाम कहते है |
हाइड्रोकार्बन का नामकरण (Nomenclature of Hydrocarbons):
हाइड्रोकार्बन अणुओं में कार्बन परमाणुओं के उपस्थिति के अनुसार नामकरण इस प्रकार होता है :
| कार्बन परमाणुओं की संख्या | नाम | एल्केन का उदाहरण (H.C) |
| 1 कार्बन परमाणु | Meth- (मेथ) | Methane मेथेन |
| 2 कार्बन परमाणु | Eth- (एथ) | Ethane एथेन |
| 3 कार्बन परमाणु | Prop- (प्रोप) | Propane प्रोपेन |
| 4 कार्बन परमाणु | But- (ब्युट) | Butane ब्यूटेन |
| 5 कार्बन परमाणु | Pent- (पेंट) | Pentane पेंटेन |
| 6 कार्बन परमाणु | Hex- (हेक्स) | Hexane हेक्सेन |
| 7 कार्बन परमाणु | Hept- (हेप्ट) | Heptane हेप्टेन |
| 8 कार्बन परमाणु | Oct- (ओक्ट) | Octane ओक्टेन |
| 9 कार्बन परमाणु | Non- (नोन) | Nonane नोनेन |
| 10 कार्बन परमाणु | Dec- (डेक) | Decane डेकेन |
हाइड्रोकार्बन तीन प्रकार के होते है और नामकरण निम्नप्रकार से होता है :
(1) एल्केन (Alkane) (एकल आबंध):
प्रकार्यात्मक समूह हेलोजन और उसका नामकरण :
-(Cl) के लिए “क्लोरो” का प्रयोग किया जाता है, (-Br) के लिए “ब्रोमो” का और (-I) के लिए “आयोडो” का प्रयोग किया जाता है |
(A) क्लोरीन के साथ एल्केन
| प्रकार्यात्मक समूह हैलोजन (क्लोरीन) का अणु सूत्र | IUPAC नाम | |
| CH3-Cl | क्लोरो-मेथेन | |
| C2H5-Cl | क्लोरो-एथेन | |
| C3H7-Cl | क्लोरो-प्रोपेन | |
| C4H9-Cl | क्लोरो-ब्यूटेन | |
| C5H11-Cl | क्लोरो-पेंटेन | |
| C6H13-Cl | क्लोरो-हेक्सेन |
(B) ब्रोमिन के साथ एल्केन
| प्रकार्यात्मक समूह हैलोजन (ब्रोमिन) का अणु सूत्र | IUPAC नाम | |
| CH3-Br | ब्रोमो-मेथेन | |
| C2H5-Br | ब्रोमो-एथेन | |
| C3H7-Br | ब्रोमो-प्रोपेन | |
| C4H9-Br | ब्रोमो-ब्यूटेन | |
| C5H11-Br | ब्रोमो-पेंटेन | |
| C6H13-Br | ब्रोमो-हेक्सेन |
(C) आयोडीन के साथ एल्केन
| प्रकार्यात्मक समूह हैलोजन (आयोडीन) का अणु सूत्र | IUPAC नाम | |
| CH3-I | आयोडो-मेथेन | |
| C2H5-I | आयोडो-एथेन | |
| C3H7-I | आयोडो-प्रोपेन | |
| C4H9-I | आयोडो-ब्यूटेन | |
| C5H11-I | आयोडो-पेंटेन | |
| C6H13-I | आयोडो-हेक्सेन |
प्रकार्यात्मक समूह अल्कोहल और उसका नामकरण:
अल्कोहल समूह का नाम देने के लिए हम हाइड्रोकार्बन के समान्य एल्केन नाम में (-ऑल) प्रत्यय लगाते हैं |
(D) अल्कोहल (Alcohol):
| प्रकार्यात्मक समूह अल्कोहल (-OH) के अणु सूत्र | IUPAC नाम | |
| CH3-OH | मेथनॉल | |
| C2H5-OH | एथेनॉल | |
| C3H7-OH | प्रोपनॉल | |
| C4H9-OH | ब्युटनॉल | |
| C5H11-OH | पेंटानॉल | |
| C6H13-OH | हेक्सानॉल |
Note: उपरोक्त उदाहरण (A), (B), (C) और (D) ये सभी समजातीय श्रेणी (Homologous series) के उदाहरण भी हैं |:
(2) एल्किन (Alkene) (द्वि-आबंध)
(3) एल्काइन (Alkyne) (त्रि-आबंध)
1. दहन (Combustion): Combustionयौगिकों के वायु के उपस्थिति में जलकर जल और कार्बन डाइऑक्साइड देने की प्रक्रिया को दहन कहा जाता है |
(i) मेथेन (CH4) की वायु में दहन की अभिक्रिया निम्नानुसार होती है :
CH4 + 2O2 → CO2 + 2H2O + ऊष्मा और प्रकाश
(ii) मेथनॉल (CH3CH2OH) वायु में दहन होने पर CO2 जल, ऊष्मा और प्रकाश देता है |
CH3CH2OH + 3O2 → 2CO2 + 3H2O + ऊष्मा और प्रकाश
उपरोक्त उदाहरण से आप देखते है कि कैसे कार्बोनिक यौगिक दहन होने पर ऊष्मा और प्रकाश देते है |
ईंधन के रूप में कार्बन यौगिक (Carbon Compound As Fuels):
अधिकांश कार्बन यौगिक जलने पर बड़ी मात्रा में ऊष्मा और प्रकाश निकालते हैं |
2. ऑक्सीकरण (Oxidation): ऑक्सीकरण वह अभिक्रिया है जिसमें कार्बन यौगिक ओक्सिकारक तत्व (oxidising agents) की उपस्थिति में ऑक्सीजन लेते है और दुसरे कार्बन यौगिक का निर्माण करते हैं |
ओक्सिकारक (Oxidising Agent): someकुछ पदार्थों में अन्य पदार्थों में ऑक्सीजन जोड़ने की क्षमता होती है इन्हें ओक्सिकारक कहते है |
उदाहरण: क्षारीय पोटैशियम परमैगनेट और अम्लिकृत पोटैशियम डाईक्रोमेट आदि आक्सीकारक हैं |
क्षारीय पोटैशियम परमैगनेट और अम्लिकृत पोटैशियम डाईक्रोमेट के द्वारा इथाइल अल्कोहल का ऑक्सीकरण:
जब क्षारीय पोटैशियम परमैगनेट या अम्लिकृत पोटैशियम डाईक्रोमेट की कुछ बुँदे हलके गर्म इथाइल अल्कोहल में डाला जाता है तो यह ओक्सिकृत हो जाता है और एक पूर्ण ऑक्सीकरण अभिक्रिया संपन्न होता है और इससे एसेटिक अम्ल का निर्माण होता है |
इस अभिक्रिया का समीकरण निम्न है :

Science Notes के अपडेटेड लगातार हासिल करने के लिए हमें Facebook पर ज्वाईन करे | Click Now
कार्बन यौगिकों के रासायनिक गुणधर्म
3. संयोजन अभिक्रिया (Addition Reaction): असंतृप्त यौगिकों को संतृप्त यौगिक बनाने के लिए परमाणु या परमाणुओं का समूह को असंतृप्त यौगिकों में जोड़ा जाता है | इसे संयोजन अभिक्रिया कहते हैं |
“वह अभिक्रिया जिसमें पदार्थ जुड़ता है संयोजन अभिक्रिया कहलाता है |”
इस अभिक्रिया का उपयोग समान्यत: निकेल उत्प्रेरक के उपयोग से वनस्पति तेलों के वनस्पतिकरण (hydrogenation) में किया जाता है |
उत्प्रेरक (Catalysts): उत्प्रेरक वे पदार्थ होते है जो बीना अभिक्रिया को प्रभावित किये अभिक्रिया दर को बढ़ा देते हैं |
असंतृप्त हाइड्रोकार्बन निकेल या पैल्लेडियम नामक उत्प्रेरकों की उपस्थिति में हाइड्रोजन जोड़ता है और संतृप्त हाइड्रोकार्बन देता है |
उदाहरण के लिए :
वनस्पतिकरण अभिक्रिया (Hydrogenation Reaction):
असंतृप्त हाइड्रोकार्बन निकेल या पैल्लेडियम नामक उत्प्रेरकों की उपस्थिति में हाइड्रोजन जोड़ता है और संतृप्त हाइड्रोकार्बन देता है |ऐसी अभिक्रिया को वनस्पतिकरण अभिक्रिया कहते है | उद्योगों में इस अभिक्रिया का उपयोग वनस्पति तेलों का वनस्पतिकरण (वनस्पति घी) करने के लिए किया जाता है |
वनस्पति तेलों में समान्यत: असंतृप्त कार्बन की लंबी श्रृंखला होती हैं जबकि जंतु वसा (animal fats) में संतृप्त कार्बन श्रृंखला होती है |
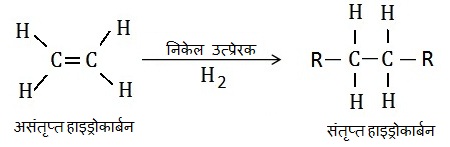
इस अभिक्रिया में असंतृप्त हाइड्रोकार्बन निकेल उत्प्रेरक की उपस्थिति में स्वयं में हाइड्रोजन जोड़कर संतृप्त हाइड्रोकार्बन देता है |
कौन-सा अच्छा है, और क्यों ?
असंतृप्त हाइड्रोकार्बन (वसा अम्ल / वनस्पति तेल) स्वास्थ्य वर्धक होते हैं | जंतुओं से प्राप्त वसा जैसे देशी घी आदि समान्यत: संतृप्त वसा अम्ल से बने होते है जो स्वास्थ्य के लिए हानिकारक होते हैं | असंतृप्त वसा अम्ल वाले तेलों को ही भोजन पकाने के लिए इस्तेमाल करना चाहिए क्योंकि ये स्वास्थ्य के लिए हानिकारण नहीं होते अपितु ये लाभदायक होते है |
4. प्रतिस्थापन अभिक्रिया (Substitution Reaction): संतृप्त यौगिकों में उपस्थित परमाणु या परमाणुओं के समूह को जब कोई परमाणु या समूह उसे प्रतिस्थापित करता है तो उसे प्रतिस्थापन अभिक्रिया कहते है |
क्लोरीन एक विषमपरमाणु है जो कार्बन यौगिकों से हाइड्रोजन को प्रतिस्थापित करता है | प्रतिस्थापन अभिक्रिया का उदाहरण (Example of substitution reaction):
जब सूर्य के प्रकाश की उपस्थिति में हाइड्रोकार्बन में क्लोरीन डाला जाता है तो यह एक एक करके हाइड्रोजन परमाणुओं को हटाता जाता है | यह बहुत ही तीव्र अभिक्रिया होता है | क्लोरीन हैलोजन प्रकार्यात्मक समूह का विषमपरमाणु है |
उदाहरण: जब क्लोरीन (Cl2) को मीथेन (CH4), से अभिक्रिया करता है तो यह क्लोरो-मीथेन और हाइड्रोक्लोरिक अम्ल देता है | इस अभिक्रिया में हाइड्रोजन का प्रतिस्थापन क्लोरीन के द्वारा होता है |
CH4 + Cl2 → CH3Cl + HCl (सूर्य-प्रकाश की उपस्थिति में)
कार्बन यौगिकों का रासायनिक गुणधर्म (Chemical properties of carbon compounds):
कार्बन यौगिकों का रासायनिक गुणधर्म निम्नलिखित हैं :
(i) अपने सभी अपररूपों में कार्बन, आॅक्सीजन में दहन करके ऊष्मा एवं प्रकाश के साथ
कार्बन डाइआॅक्साइड देता है।
(ii) दहन पर अधिकांश कार्बन यौगिक भी प्रचुर मात्रा में ऊष्मा एवं प्रकाश को मुक्त करते हैं।
(iii) दहन करने पर कार्बन यौगिकों को सरलता से आॅक्सीकृत किया जा सकता है।
(iv) पैलेडियम अथवा निकेल जैसे उत्प्रेरकों की उपस्थिति में असंतृप्त हाइड्रोकार्बन हाइड्रोजन जोड़कर संतृप्त हाइड्रोकार्बन देते हैं।
(v) संतृप्त हाइड्रोकार्बन अत्यधिक अनभिक्रित होते हैं तथा अधिकांश अभिकर्मकों की
उपस्थिति में अक्रिय होते हैं।
दहन करने पर संतृप्त और असंतृप्त हाइड्रोकार्बन के गुण :
- संतृप्त हाइड्रोकार्बन से सामान्यतः स्वच्छ ज्वाला निकलेगी जबकि असंतृप्त कार्बन यौगिकों से अत्यधिक काले धुएँ वाली पीली ज्वाला निकलेगी।
संतृप्त हाइड्रोकार्बन द्वारा कजली वाला ज्वाला का देना :
वायु की आपूर्ति को सीमित कर देने से हाइड्रोकार्बन का पूर्ण दहन नहीं हो पाता है और इस अपूर्ण दहन होने पर संतृप्त हाइड्रोकार्बनों से भी कज्जली ज्वाला निकलती है। घरों में उपयोग में लाई जाने वाली गैस /केरोसीन के स्टोव में वायु के लिए छिद्र होते हैं जिनसे पर्याप्त मात्रा में आॅक्सीजन-समृद्ध मिश्रण जलकर स्वच्छ नीली ज्वाला देता है।
बर्तनों के तली काली पड़ जाती है इसका अर्थ है कि :
(i) वायु छिद्र बंद हैं |
(ii) ऑक्सीजन कि पूर्ति ठीक ढंग से नहीं मिल रही है |
(iii) आपका ईंधन बर्बाद हो रहा है |
कोयले और पेट्रोलियम को जलाने से नुकसान :
(i) इनके दहन के फलस्वरूप सल्फर तथा नाइट्रोजन के आॅक्साइड का निर्माण होता है जो पर्यावरण में प्रमुख प्रदूषक हैं।
(ii) कोयले और पेट्रोलियम के अपूर्ण दहन से कजली वाली ज्वाला निकलती है |
(iii) कार्बन और पेट्रोलियम के अपूर्ण दहन से कार्बन मोनोऑक्साइड नाम का एक खतरनाक प्रदूषक निकलता है |
कोयले और पेट्रोलियम का अपूर्ण दहन:
(i) कोयले और पेट्रोलियम के अपूर्ण दहन से कजली वाली ज्वाला निकलती है |
(ii) कार्बन और पेट्रोलियम के अपूर्ण दहन से कार्बन मोनोऑक्साइड नाम का एक खतरनाक प्रदूषक निकलता है |
कुछ इधनों का बीना ज्वाला के साथ जलने का कारण:
अँगीठी में जलने वाला कोयला या तारकोल कभी-कभी लाल रंग के समान उज्ज्वल होता है तथा बिना ज्वाला के ऊष्मा देता है। ऐसा इसलिए होता है क्योंकि केवल गैसीय पदार्थों के जलने पर ही ज्वाला उत्पन्न होती है। लकड़ी या तारकोल जलाने पर उपस्थित वाष्पशील पदार्थ वाष्पीकृत हो जाते हैं तथा आरंभ में ज्वाला के साथ जलते हैं।
कुछ पदार्थो का दीप्त जवाला के साथ जलना:
गैसीय पदार्थों के परमाणुओं को ताप देने पर एक दीप्त ज्वाला दिखाई देती है तथा उज्ज्वल होना आरंभ करती है। प्रत्येक तत्व के द्वारा उत्पन्न रंग उस तत्व का अभिलाक्षणिक गुण होता है।
कोयले एवं पेट्रोलियम का निर्माण (Formation of coal and petroleum):
समान्यत: एथेनॉल को अल्कोहल कहा जाता है |
एथेनॉल का भौतिक गुणधर्म:
(i) एथेनॉल कमरे के तापमान पर द्रव्य अवस्था में पाया जाता है |
(ii) यह एक अच्छा विलायक है |
(iii) एथेनॉल पानी से सभी अनुपातों में घुलनशील है |
(iv) इसकी दहनशीलता काफी उच्च है |
एथेनॉल का रासायनिक गुणधर्म:
(i) दहन (Combustion): एथेनॉल ऑक्सीजन के साथ जलकर कार्बन डाइऑक्साइड और जल प्रदान करता है |
(ii) निर्जलीकरण (Dehydration): सान्द्र सल्फ्यूरिक अम्ल के साथ गर्म करने पर यह इसका निर्जलीकरण हो जाता है | इसमें से जल के अणु बाहर निकल जाते हैं क्योंकि सान्द्र सल्फ्यूरिक अम्ल एक प्रबल निर्जलिकारक पदार्थ है |
(iii) ऑक्सीकरण (Oxidation): क्षारीय पोटैशियम परमैगनेट या अम्लिकृत पोटैशियम डाईक्रोमेट जैसे ओक्सिकरकों के उपयोग से कार्बोनिक यौगिकों का ऑक्सीकरण किया जा सकता है | क्योंकि ये पदार्थ कार्बन यौगिकों में ऑक्सीजन जोड़ते हैं |
(iv) एस्ट्रीकरण (Estrification): एथेनॉल की कार्बोक्सिलिक अम्ल के साथ अभिक्रिया से एस्टर का निर्माण होता है |
एथेनॉल का उपयोग (Uses of Ethanol):
(i) यह सभी एल्कोहाली पेय पदार्थों का महत्वपूर्ण अवयव होता है |
(ii) उद्योगों में इसका उपयोग एक अच्छे विलायक के रूप में भी होता है |
(iii) इसका उपयोग टिंचर आयोडीन, कप़ सीरप, टाॅनिक आदि जैसी औषधियों में होता है।
(iv) औद्योगिक मिथाइलेटेड स्प्रिट बनाने के लिए | .
(v) इसकों जलाने पर कार्बन डाइऑक्साइड और जल देता है इसलिए इसका उपयोग एक ईंधन के रूप में हो सकता है |
एथेनॉल/एल्कोहल पीने के हानिकारक प्रभाव :
(i) इथेनॉल की छोटी मात्रा में उपभोग से मादकता/नशा आ जाता है।
(ii) एथेनॉल के अल्पकालिक उपयोग से उल्टी और सिरदर्द, लड़खाती जुबान, उनींदापन आदि का कारण बनता है
(iii) एथेनॉल की लंबी अवधि उपयोग से अल्कोहल विषाक्त, यकृत रोग, तंत्रिका क्षति और मस्तिष्क के स्थायी क्षति के रूप में कई स्वास्थ्य समस्याओं से पिने वाला व्यक्ति ग्रसित हो जाता है
(iv) यह चयापचय की प्रक्रिया को धीमा करता है और केंद्रीय तंत्रिका तंत्र कमजोर हो जाता है। यह सामान्य संकोच को कम करने, समन्वय की कमी, मानसिक भ्रम, उनींदापन तथा भावशुन्यता लाता है |
विकृत एल्कोहल: औद्योगिक उपयोग के लिए तैयार एथनाॅल का दुरुपयोग रोकने के लिए इसमें मेथेनाॅल जैसा शहरीला पदार्थ मिला दिया जाता है जिससे यह पीने योग्य न रह जाए। ऐल्कोहाॅल की पहचान करने के लिए इसमें रंजक मिलाकर इसका रंग नीला बना दिया जाता है। इसे विकृत ऐल्कोहाॅल कहा जाता है।
एथेनॉल की अभिक्रिया:
(i) सोडियम के साथ अभिक्रिया (Reaction with Sodium): एल्कोहल सोडियम के साथ अभिक्रिया करने पर हाइड्रोजन गैस निकलता है और एक अन्य पदार्थ सोडियम एथोऑक्साइड का निर्माण करता है |
इस अभिक्रिया का समीकरण इस प्रकार है :
2Na + 2CH3CH2OH → 2CH3CH2O–Na+ + H2
(सोडियम एथोऑक्साइड)
(ii) असंतृप्त हाइड्रोकार्बन प्राप्त करने के लिए अभिक्रिया : 443k तापमान पर एथनाॅल को
अधिक्य सांद्र सल्फ्ऱ यूरिक अम्ल के साथ गर्म करने पर एथनाॅल का निर्जलीकरण
होकर एथीन बनता है।

एथेनोइक अम्ल (CH3COOH):
एथेनाॅइक अम्ल को सामान्यतः ऐसीटिक अम्ल कहा जाता है तथा यह कार्बोक्सिलिक अम्ल समूह से संबंधित है।
इस समूह को कार्बोक्सिलिक अम्ल समूह कहते है |
- एसिटिक अम्ल के 3-5% विलयन को सिरका कहा जाता है और इसका आचार में परिरक्षक के रूप में इस्तेमाल किया जाता है |
- शुद्ध एथनाॅइक अम्ल का गलनांक 290 k होता है और इसलिए ठंडी जलवायु में शीत के दिनों में यह जम जाता है। इस कारण इसे ग्लैशल ऐसीटिक अम्ल कहते हैं।
एथेनोइक अम्ल का गुण:
(i) इसकी प्रकृति अम्लीय होती है |
(ii) एथेनोइक अम्ल एक गंधहीन पदार्थ है |
(iii) एथनाॅइक अम्ल का गलनांक 290 k होता है |
एसेटिक अम्ल / एथेनोइक अम्ल का उपयोग:
एथेनोइक अम्ल का उपयोग निम्नलिखित है :
(i) आचारों के परिरक्षण के लिए इसका उपयोग सिरका के रूप में किया जाता है |
(ii) इसका उपयोग लेबोरेटरी अभिकर्मक के रूप में किया जाता है |
(iii) सफ़ेद शीशे के निर्माण में इसका उपयोग होता है |
(iv) रेयोन रेशों के निर्माण में इसका उपयोग होता है |
(v) एसिटिक अम्ल रबड के निर्माण में एक स्कंदन (ज़माने वाला) के रूप में प्रयोग किया जाता है।
(vi) इसका उपयोग एक विलायक के रूप में भी होता है |
एथेनोइक अम्ल की अभिक्रिया (Reactions of ethanoic acid):
(i) एस्ट्रीकरण अभिक्रिया (Esterification reaction): एस्टर मुख्य रूप से अम्ल एवं ऐल्कोहाॅल की अभिक्रिया से निर्मित होते हैं। एथेनाॅइक अम्ल किसी अम्ल उत्प्रेरक की उपस्थिति में परिशुद्ध एथनाॅल से अभिक्रिया करके एस्टर बनाते हैंः
इसका अभिक्रिया इस प्रकार होता है :
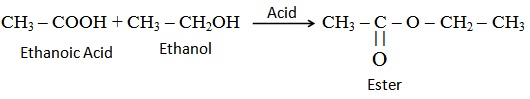
एस्टर (Ester): एथेनॉल एवं एथेनोइक अम्ल के आपसी अभिक्रिया से बनने वाले यौगिक को एस्टर कहते है | इसका अणु सूत्र CH3COOCH2CH3 है |
एस्टर का उपयोग (Uses of Esters):
एस्टर एक मीठी गंध वाला पदार्थ है इसका उपयोग निम्नलिखित है :
(i) इसका उपयोग इत्र बनाने एवं स्वाद उत्पन्न करने वाले कारक के रूप में किया जाता है।
(ii) इसका उपयोग साबुन एवं डिटर्जेंट बनाने में किया जाता है |
(iii) कुछ एस्टरों का उपयोग बहुलक बनाने में किया जाता है जिसे पॉलिएस्टर कहते हैं |
एस्ट्रीकरण अभिक्रिया (Esterification reaction): वह अभिक्रिया जिससे एस्टर का निर्माण होता है एस्ट्रीकरण कहलाता है |
साबुनीकरण (Saponification): अम्ल या क्षारक की उपस्थिति में एस्टर से पुन: एथेनॉल एवं एथेनोइक अम्ल बनने की प्रक्रिया को साबुनीकरण कहते है |
क्योंकि एस्टर का उपयोग साबुन बनाने के लिए किया जाता है |
साबुनीकरण अभिक्रिया का समीकरण :
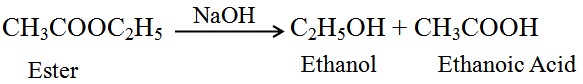
(ii) क्षारक के साथ अभिक्रिया (Reaction with a base): खनिज अम्ल की भाँति एथेनाॅइक अम्ल सोडियम हाइड्रोक्साॅइड जैसे क्षारक से अभिक्रिया करके लवण (सोडियम एथेनोएट या
सोडियम ऐसीटेट) तथा जल बनाता है।
NaOH + CH3COOH → CH3COONa + H2O
(iii) कार्बोनेट एवं हाइड्रोजनकार्बोनेट के साथ अभिक्रिया: एथेनाॅइक अम्ल कार्बोनेट एवं
हाइड्रोजनकार्बोनेट के साथ अभिक्रिया करके लवण, कार्बन डाइआॅक्साइड एवं जल
बनाता है। इस अभिक्रिया में उत्पन्न लवण को सोडियम ऐसीटेट कहते हैं।
2CH3COOH + Na2CO3 → 2CH3COONa + H2O + CO2
CH3COOH + NaHCO3 → CH3COONa + H2O + CO2
साबुन एवं डिटर्जेंट
साबुन एवं डिटर्जेंट (Soap and Detergent):
साबुन (Soap): साबुन के अणु लंबी श्रृंखला वाले कार्बोक्सिलिक अम्लों के सोडियम एवं पोटैशियम लवण होते हैं। साबुन का आयनिक भाग जल में घुल जाता है जबकि कार्बन शृंखला तेल में घुल जाती है। साबुन अपनी सफाई प्रक्रिया मिसेल की संरचना बना कर करता है |
मिसेल (Micelles): जब साबुन जल की सतह पर होता हैं तब इसके अणु अपने को इस प्रकार व्यवस्थित कर लेते हैं कि इनका आण्विक सिरा जल के अंदर होता हैं जबकि हाइड्रोकार्बन पूँँछ जल के बाहर होता हैं जो तैलीय मैल को अपने केंद्र में एकत्रित कर लेता है | ऐसा अणुओं का बड़ा समूह बनने के कारण होता हैं । इस संरचना को मिसेल कहते हैं ।
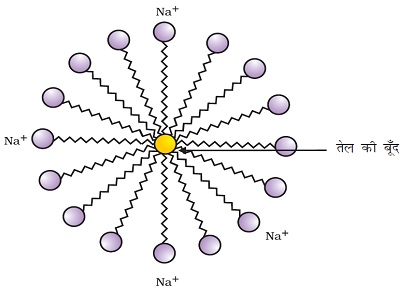
मिसेल की संरचना बनने के लिए साबुन के अणुओं में उनकी सिराओं का महत्वपूर्ण भूमिका है | इनकी दो सिरायें होती हैं :
(i) जलरागी सिरा (Hydrophilic end) : साबुन के अणु के दो सिरों में से एक सिरा जो जल में घुलनशील होता है उसे जलरागी कहते है |
(ii) जलविरागी सिरा (Hydrophobic end) : साबुन के अणु का वह सिरा जो हाइड्रोकार्बन में अर्थात तैलीय मैल में विलेय होता है जलविरागी सिरा कहलाता है |

जलरागी और जलविरागी सिरे में अंतर:
जलरागी सिरा:
(i) यह जल में विलेय होता है |
(ii) यह आयनिक सिरा होता है |
(iii) यह मिसेल की संरचना में बाहर की ओर जल में घुला होता है |
जलविरागी सिरा :
(i) यह जल में विलेय नहीं होता बल्कि हाइड्रोकार्बन (तेल) में विलेय होता है |
(ii) यह आयनिक सिरा नहीं होता है |
(iii) यह मिसेल की संरचना में अन्दर के हिस्से में तेलिय भाग की ओर होता है |
साबुन की सफाई प्रक्रिया:
साबुन की सफाई प्रक्रिया मिसेल के द्वारा होती है | साबुन के अणुओं की आयनिक सिरा जल में रहता है और दूसरा हाइड्रोकार्बन पूँँछ तैलीय मैल ने घुल जाता है और मिसेल संरचना का निर्माण करते हैं । मिसेल के रूप में साबुन स्वच्छ करने के रूप में सक्षम होता हैं क्योंकि तेलीय मेैल मिसेल के केन्द्र में एकत्रित हो जाते है। इससे पानी में इमल्शन बनता है | मिसेल विलयन में कोलाइड के रूप में बने रहते हैं। साबुन का मिसेल मैल को पानी में घुलाने में मदद करता है और इस प्रकार मिसेल में तैरते समय मेल आसानी से हट जाते है और हमारे कपडे साफ हो जाते है ।
मिसेल के गुण:
(i) मिसेल के रूप में साबुन सफाई करने में सक्षम होता है |
(ii) मिसेल विलयन में कोलाइडल के रूप में बना रहता है |
(iii) यह आयन-आयन विकर्षण के कारण अवक्षेपित नहीं होते हैं |
(iv) साबुन के मिसेल प्रकाश को प्रकीर्णित कर सकते हैं |
(v) साबुन का मिसेल मैल को पानी में घुलाने में मदद करता है |
साबुन कठोर जल के साथ झाग नहीं बनाता है :
जब हम कठोर जल के साथ साबुन से साथ धोते है तो देखते है झाग बड़ी मुश्किल से बन रहा है एवं जल से शरीर धो लेने के बाद भी कुछ अघुलनशील पदार्थ (स्कम) जमा रहता है। ऐसा इसलिए होता है, क्योंकि साबुन कठोर जल में उपस्थित कैल्सियम एवं मैग्नीशियम लवणों से अभिक्रिया करता है। ऐसे में आपको अधिक मात्रा में साबुन का उपयोग करना पड़ता है।
अपमार्जक कठोर जल में भी प्रभावी है :
अपमार्जक लंबी कार्बोक्सिलिक अम्ल श्रृंखला के अमोनियम एवं सल्फोनेट लवण होते है। इन यौगिकों का आवेशित सिरा कठोर जल में उपस्थित कैल्शियम एवं मैग्नीशियम आयनों के साथ अघुलनशील पदार्थ नहीं बनाते हैं। इस प्रकार वह कठोर जल में भी प्रभावी बने रहते हैं।
साबुन एवं अपमार्जक में अंतर :
साबुन:
(i) साबुन के अणु लंबी श्रृंखला वाले कार्बोक्सिलिक अम्लों के सोडियम एवं पोटैशियम लवण होते हैं।
(ii) यह कठोर जल में प्रभावी नहीं है, इसलिए झाग नहीं बनाता है |
(iii) इसकी सफाई प्रक्रिया में मिशेल का निर्माण होता है |
(iv) यह जल की कठोरता को बढाता है |
अपमार्जक :
(i) अपमार्जक लंबी कार्बोक्सिलिक अम्ल श्रृंखला के अमोनियम एवं सल्फोनेट लवण होते है।
(ii) यह कठोर जल में प्रभावी है, इसलिए झाग बनाता है |
(iii) इसकी सफाई प्रक्रिया में मिशेल का निर्माण नहीं होता है |
(iv) यह जल की कठोरता को कम करता है |
अपमार्जक का उपयोग:
(i) अपमार्जकों का उपयोग शैंपू एवं कपड़े धोने के उत्पाद बनाने में होता है।

